


I. 介绍
本指南提供的建议是关于提交下列申请时,在涉及制剂产品中归类为降解产物的杂质的报告、鉴定和界定方面,申请者应该递交什么样的化学、生产和控制(CMC)信息。
● 首次简化新药申请(ANDAs)
● 可能影响定量或定性的降解产物概况的变更的ANDA补充申请
本指南同样为建立仿制药制剂中降解产物 (特别是活性成分的降解产物或活性成分与辅料和/或直接接触的容器/包材的反应产物)的可接受标准提供建议。本指南同时将替换现有的同名的1998年的指南草案。
FDA的指南文件,包括本指南,都不是强制性的法律要求。相反,这些指南代表了管理当局对某个问题当前的想法,应当看作只是建议,除非引用了具体的法规要求。FDA指南中所用单词“应该(should)”的意思是建议或推荐,而不是必须要求。
II. 背景
2005年8月29日,FDA出版了原1998年12月发布的标题为:“ANDAs:制剂产品中的杂质”的工业指南草案的修订版。
基于下述原因,我们发布了本最终版指南:
1. 更新AN DAs中降解产物的列出、可接受标准的设定和对降解产物的界定(阈值和方法)的有关内容,使其与修订的工业指南Q3B(R)“新制剂产品中的杂质”保持一致。
2. 去掉那些因为已在最新的Q3B(R)中写明,而不需要在1998年指南草案中包含的有关建议部分(见下面列表)。
Q3B(R)是ICH开发的关于新药申请(NDAs)制剂中的杂质的指南,然而,当局相信所提供的许多建议同样适用于ANDAs,这些建议请参考Q3B(R)中的下列特定章节:
● 第I节:介绍
● 第II节:降解产物报告和控制的基本原则
● 第III节:分析方法
● 第IV节:报告降解产物,批产品中的含量
● 附件1:降解产物的阈值
III.制剂标准中降解产物的列出及其可接受标准的设定
A. 降解产物的列出
我们建议制剂标准中需列出降解产物。稳定性研究、化学开发研究和日常批分析可以用来预测存在于商业批产品中的降解产物概况。根据商业化生产工艺生产的批产品中发现的降解产物而制定制剂标准中的降解产物名单是非常重要的。
我们建议申请人提交的资料中,应包含将降解产物纳入和排除在制剂标准中的基本原则的说明。该基本原则中要含有对稳定性试验和其它支持申请所生产的任何批次中观察到的杂质概况的讨论,这点非常重要。
在本指南中,包含在制剂标准中的具有确定的可接受标准的单个降解产物被称为“特定降解产物”。特定降解产物可以是已鉴定的或未鉴定的。
我们建议,那些预计会高于Q3B(R)中鉴别阈值的特定已鉴定降解产物,连同特定未鉴定降解产物,都应该包含在制剂标准的降解产物名单中。对于已知具有不同寻常效能的或产生毒性或非期望的药理作用的降解产物,建议分析方法的定量水平和/或检测限应符合该降解产物所期望控制的限度水平。
对列入制剂标准中的未鉴定降解产物,我们建议申请人清楚地描述建立该降解产物限度水平所用的分析方法和所做的设想。采用适当的定性分析描述(如:未鉴定降解产物A,相对保留时间为0.9的未鉴定降解产物)来标识特定的非鉴定降解产物是很重要的。同样地,建议设定任一非特定降解产物的一般可接受标准为不得大于鉴定限(参见Q3B(R),附录1),并设定总降解产物的可接受标准。
我们建议制剂标准,如适用的话,应列出以下类型的降解产物:
● 各特定的已鉴定降解产物
● 各特定的未鉴定降解产物
● 任一非特定降解产物的可接受标准不得大于(≤)附录1 Q3B(R)中的鉴定阈值
● 总降解产物
B.降解产物可接受标准的设定
我们建议,可接受标准不能高于界定水平(见第IV节,降解产物的界定)。在建立降解产物的可接受标准时,首先要考虑的是该降解产物是否在美国药典(USP)中已有规定。如果USP的某个专论种含有某一个特定已鉴定降解产物的限度时,建议该可接受标准不能高于官方药典的限度。
如果特定的已鉴定降解产物的水平高于USP中所规定的限度,建议进行界定。然后,如果得到了适当的界定,申请人可以请求USP修订该降解产物的可接受标准。
如果某一个特定降解产物的限度不在USP中,建议通过与参比制剂(RLD)进行比较来界定该杂质,其可接受标准应与RLD中观测到的限度水平相似。否则,可接受标准应设定得比界定水平低以保证制剂产品的质量。例如,如果重要的代谢杂质的含量水平太高的话,其他质量属性,如效力,可能受到严重影响。这种情况下,我们建议降解产物的可接受标准应设定得比界定水平低。
我们建议ANDA申请方基于合理的最先进的技术科学和工程原理和知识来开发优良稳定的制剂和生产工艺。、
虽然日常生产的可变性是在预料之内的,但如果批与批产品间的降解产物水平有明显变化或 出现不同寻常的高水平的降解产物,可能表明该制剂产品的生产工艺在控制或设计方面存在不足。
IV.降解产物的界定
界定是获得和评估数据的过程,这个数据考虑的是某一个降解产物或给定降解杂质的具生物安全性的含量水平。如果适合,我们建议申请人提交包含安全性考虑在内的建立降解产
物可接受标准的基本原则。
符合下列一个或多个条件时,一个特定的已鉴定降解产物被认为是界定了的:
● 降解产物的观测水平和设定的可接受标准未超过参比制剂(RLD)中的观测水平。
● 降解产物是原料药的一个重要代谢产物。
● 降解产物的观测水平和设定的可接受标准有充分的科学文献论证。
● 降解产物的观测水平和设立的可接受标准没有超过已被毒理研究充分评估的水平。
虽然定量的构效关系可用来推测某一个降解产物或给定降解产物的毒性,但其结果一般不被认为对杂质的界定是令人信服的。
A. 界定阈值
Q3B(R)提供了基于制剂的最大日剂量来设置的推荐的界定阈值。当超过这些界定阈值时,我们建议降解产物的水平要经过界定。在一些情况下,增加或降低界定降解产物的界定阈值是合适的。例如,当有证据事先已表明在特定药物分类或治疗分类中的某一个降解产物是与病人的副作用有关联的时候,建立一个较低的界定阈值是很重要的。相反,与安全性关系不大时,提高界定降解产物的界定阈值可能是适宜的。FDA将结合诸如发病人群、药物分类效应和历史安全性数据,根据具体情况来考虑提出替代界定阈值的申请的合理性。
B.界定方法
附录中的决策树描述了当降解产物水平超过了常规界定阈值时应考虑的界定事项。在某些情况下,将降解产物水平降至不大于阈值是最简便的方式,而不是去提供安全性数据。或者,也可以提供足够的科学文献来界定降解产物。合理的界定一个降解产物的研究将取决于许多因素,包括病例数、日剂量、给药途径与服药周期。这些试验虽然可用分离出来的降解产物进行,但通常是用含有需被控制的降解产物的新药制剂或原料药来进行。下面的内容描述了界定降解产物的方法。
1.对比分析研究
ANDA涵盖的制剂中存在的降解产物,可以通过采用同样的经验证的稳定性指示分析方法(如:对比HPLC研究),将仿制药和RLD的分析结果进行对比,从而得到界定。不过,如果参比制剂无法获得的情况下,其降解产物数据可以与相同给药途径或类似属性(如:片剂相对胶囊)的不同制剂比较。通过比较分析研究来界定时,考虑到降解产物的最大日用量和给药途径是很重要的。如果最大日用剂量或给药途径不同的话,某剂型中某降解产物的界定限度可能不适用于含有该降解产物的所有制剂。我们建议,对可比的样品(如:同样时长的样品(age of samples))进行稳定性研究,以获得有有关降解产物的有价值的对比研究。如果在仿制药制剂中存在的降解产物的量与RLD中观测到的水平相似,则可以认为该特定降解产物是被界定的。
2. 科学文献和重要代谢产物
如果特定的已鉴定降解产物的限度水平被科学文献充分地论证了,则没有必要进行进一步的界定。另外,降解产物同时是制剂的重要代谢产物的话,通常认为该降解产物是被界定的。
3. 毒理研究
毒性试验是界定降解产物最后选择的方法。我们建议,仅在杂质不能使用上述方法(第IV节,B.1或2)中任意一种方法界定时才采用该试验。该试验是设计用来检测在试验系统中诱发一般毒性或基因毒性作用的化合物。实施此种试验时,应该用含有需被控制的降解产物的新药制剂或原料药来进行,虽然也可用分离出来的降解产物来进行。
附件:仿制药制剂中杂质的鉴定和界定
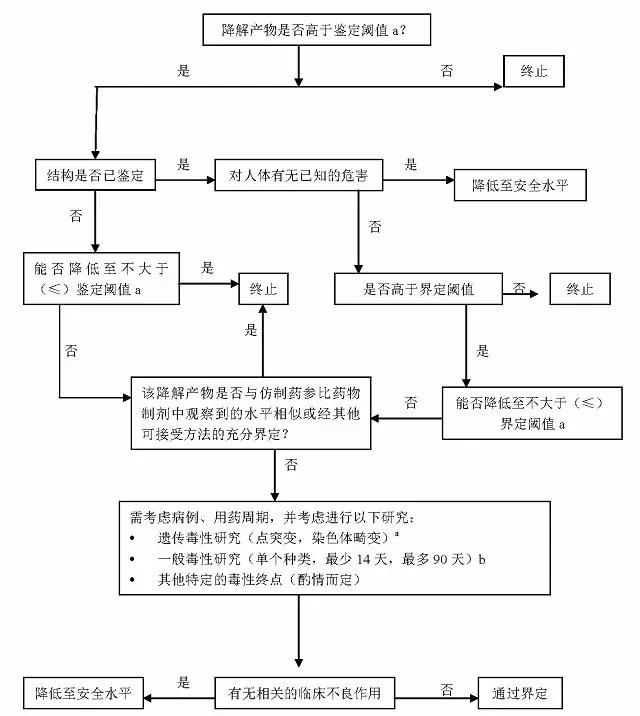
附件注释
1.如果降解产物具有不同寻常毒性,则较低的限度是适宜的。
2.比如,已知的降解产物的安全性数据或其结构的分类是否排除了人接触该浓度杂质的可能?
3.当符合下列一个或多个条件时, ANDA中降解产物是被认为是界定了的:
● 降解产物的观测水平和设定的可接受标准未超过参比制剂(RLD)中的观测水平。
● 降解产物是原料药的一个重要代谢产物。
● 降解产物的观测水平和设定的可接受标准有充分的科学文献论证。
● 降解产物的观测水平和设立的可接受标准没有超过已被毒理研究充分评估的水平。
4.如需要,应进行最低限度(如潜在遗传毒性)筛选试验,进行体外点突变和染色体畸变试验被认为是合适的最低限度筛选试验。
5.如需进行一般毒理研究,应设计一个或多个研究方案,以将未界定的物质与界定的物质进行比较。研究时间应根据可用的相关信息而定,并使用最能反映某一降解产物毒性的动物种属,根据个案分析的原则,可进行单剂量给药试验,尤其是对单剂量给药的药物。一般最短14天,最多90天。