


一、MAH业务介绍:
药品上市许可持有人是指取得药品注册证书的企业或者药品研制机构等。
药品上市许可持有人制度(MAH)的核心内容是药品批准文号和生产许可脱离,允许试点的药品研发机构和科研人员取得药品的批准文号,并且对药品质量承担相应的责任。
MAH制度出台之前,我国也有相似的制度:委托生产制度和技术转让制度。
值得注意的是,委托生产制度并不是生产许可和上市许可唯一准入制度下面的一个产物,根据现在的委托生产的规定,只能委托生产企业有这个批准文号的企业来委外,也是委托方和受托方均为生产企业,而且本身的批准文号是不随委托进行变更的。可以说,委托生产本身只是在持有企业拥有技术改造等不具备生产条件下的暂时性的安排。
MAH在国际社会其实早已通行,主流的发达国家和地区普遍采取了药品上市许可持有人制度。
二、项目工作流程:
我公司依托专业的实验室及认证咨询团队,具备丰富的申报经验。针对不同类型的客户,可提供定制化服务,帮助客户建立或优化质量管理体系,优化人员配置,打通申报通道,使得客户能够在最短的时间内取得药品生产许可。工作流程如下:
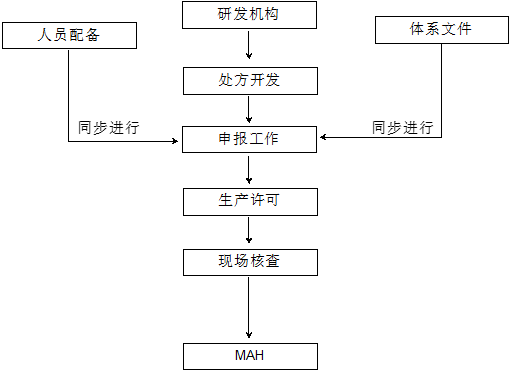
三、重要的先决条件:
1. 研发机构或企业;
2. 配备足够的人员;
3. 建立完整的体系。
四、合作方式与时效:
工作事项 | 凯瑞科德工作内容 | 甲方工作内容 | 时间周期 |
整体规划 | 提供现场工作计划,首次现场工作2-4个工作日: 1、全方位了解甲方现场及人员情况; 2、项目流程介绍; 3、甲方基础资料数据梳理; 4、根据现场工作情况,输出工作任务列表。 | 1、按照工作计划,对应部门配合现场工作 2、确认工作任务列表 | 签约后的5个工作日内 |
体系文件详细列表及分级 | 结合首次现场工作,提供体系文件及记录的详细列表,包括需补充完善事项。 | 对乙方提供的体系文件列表进行评估、校正 | 首次工作后5个工作日内完成 |
体系文件编纂 | 起草《文件管理规程》确定文件格式及编号规则; 根据体系文件列表,起草体系文件主体内容。 | 对乙方提供的体系文件内容,根据实际情况进行校对,并确认; 将定稿文件进行格式校对。 | 体系文件列表确定后90个工作日内完成 |
体系文件试运行 | 查漏补缺,完善甲方提出的增补文件; | 体系文件试运行; 提出运行过程的问题,并要求乙方整改。 | 试运行期间40个工作日 |