


1. 基本情况
名称:富马酸替诺福韦艾拉酚胺(Tenofovir Alafenamide Fumarate)
别名:TAF,GS-7340-02,富马酸磷丙替诺福韦
商品名:Vemlidy
剂型:片剂
规格:25mg(以替诺福韦艾拉酚胺计),28mg(以替诺福韦艾拉酚胺半富马酸盐计)
适应症:用于乙肝病毒感染(HBV)和获得性免疫综合征(HIV)的治疗
用法用量: 每日一次用于治疗乙肝病毒感染等相关疾病的治疗
结构式:
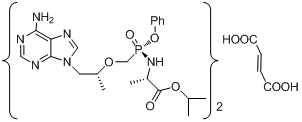
分子式:(C21H29N6O5P)2. C4H4O4
分子量:1069.00
化学名:N-[(S)-[[(1R)-2-(6-amino-9H-purin-9-yl)-1-methylethoxy]methyl]phenoxyphosphinyl]-L-alanine 1-methylethyl ester
9-[(R)-2-[(S)-1-(异丙氧基羰基)乙基]氨基]苯氧基氧膦基]甲氧基]丙基]腺嘌呤半富马酸盐
CAS登录号:379270-37-8(游离碱);1392275-56-7(半富马酸盐)
上市情况:
本品由Gilead Sciences研发,2016.11获美国FDA批准上市,商品名为Vemlidy(1瓶30粒),2016.12日本上市,(1瓶14粒),2017.01欧盟上市。
注册类别:化药4类
国内未上市,原研申报正在进行三期临床试验,仿制药只有正大天晴1家以艾酚福韦2.1类申报临床
2. 药理作用:
富马酸替诺福韦艾拉酚胺(TAF)是一种新型核苷类逆转录酶抑制剂(NRTI),由美国吉利德科学公司研发,是近十年来美国食品药品管理局(FDA)再次批准治疗成人慢性乙型肝炎的新药;TAF在血液内降解成活性物质替诺福韦,进而进入肝脏细胞转变为活性代谢产物替诺福韦双磷酸盐(tenofovir diphosphate,DP),通过直接竞争性地与天然脱氧核糖底物相结合而抑制病毒聚合酶,及通过插人DNA中终止链,抑制逆转录酶,从而通过抑制HIV-1逆转录酶的活性抑制HIV病毒复制,进而发挥抗乙肝病毒感染(HBV)和获得性免疫综合征(HIV)的疗效。
3.市场前景:
目前中国市场上一共有五种口服乙肝抗病毒药:拉米夫定,阿德福韦酯,替比夫定,替诺福韦和恩替卡韦。考虑其耐药性和抗病毒效果,拉米夫定,阿德福韦酯,替比夫定,这三种药,无论是从耐药性,抗病毒效果,或者经济学,都不做推荐。首先推荐不易产生耐药性的核苷(酸)类似物(替诺福韦和恩替卡韦)作为乙肝的一线用药,其中替诺福韦因其极低的耐药性,且与其他口服乙肝抗病毒药物的没有交叉耐药性,临床应用尤其广泛。
根据数据显示,作为乙肝的一线用药,使用替诺福韦(TDF)治疗八年,有98%的HBeAg阳性患者以及99.6%的HbeAg阴性患者实现了病毒学应答,并且没有发生耐药。但是该药物也并非是十全十美,作为每片300mg的制剂,在长期治疗的过程中,一些患者会发生肾损伤及骨质疏松事件。并且由于乙肝患者的年龄增大,并发症会越来越多。
而TAF作为TDF的升级版,因其具有较高的血液稳定性,可以有效递达至肝细胞,因此TAF 在剂量低于TDF十分之一(25mg/300mg) 的情况下就能发挥与后者相似的疗效,血浆内浓度低90%,而细胞内浓度高却4倍,避免血液中替诺福韦浓度过高,增强疗效同时提高了安全性,可改善肾功能和骨骼安全参数,且也更有利于研制复方制剂,具有极大的临床价值和市场。
4. 知识产权情况
化合物及用途专利
核苷酸膦酸酯类似物前药及其筛选和制备方法CN 200410097845.3和CN 01813161.1于2001.07申请,已授权,2021年到期;
盐型、晶型和制剂用途专利
替诺福韦艾拉酚胺(TENOFOVIR ALAFENAMIDE)半反丁烯二酸盐CN201280039891.0于2012.08申请,还未授权,处在实审阶段
5.制备工艺
原料药合成工艺:
以替诺福韦(PMPA)为起始物料,经缩合酯化,氯化亚砜氯代,与L-丙氨酸异丙酯酰化得替诺福韦艾拉酚胺游离碱,与富马酸成盐得替诺福韦艾拉酚胺半富马酸盐,精制得富马酸替诺福韦艾拉酚胺,路线如下:

小试工艺共三步反应和一步精制,总收率30~35%。
制剂:本品为黄色薄膜衣片,圆形,一侧刻有凹陷GSI刻痕,另一侧显示25
规格:替诺福韦艾拉酚胺25mg=富马酸替诺福韦艾拉酚胺28mg。
富马酸替诺福韦艾拉酚胺的辅料:
片芯:交联羧甲纤维素钠、一水乳糖(95mg),硬脂酸镁,结晶纤维素。
包衣:黄色三氧化二铁,聚乙二醇4000,聚乙烯醇(部分皂化物)、滑石粉、二氧化钛。
片重208mg 直径8mm,片厚4mm
6.周期:
开发周期:
合成小试,质量分析方法的建立与验证,制剂小试,杂质对照品的制备:6+2个月;
原料药和制剂的中试与验证: 1+1+1个月;
稳定性考察和注册:6~7个月
共计约18个月